Agencja Oceny Technologii Medycznych i Taryfikacji jest opiniodawczo-doradczą jednostką organizacyjną posiadającą osobowość prawną, nadzorowaną przez ministra właściwego ds. zdrowia.
Rolą Agencji jest wspomaganie ministra właściwego ds. zdrowia w procesie podejmowania decyzji dotyczących finansowania świadczeń lekowych i nielekowych w systemie ochrony zdrowia.
Wykorzystywana w tym celu ocena technologii medycznych (ang. Health Technology Assessment, HTA) w sposób:
- powtarzalny;
- przejrzysty;
- w określonym standardzie metodologicznym;
- w oparciu o dowody naukowe zgodnie z EBM (ang. Evidence-Based Medicine),
dostarcza ministrowi właściwemu do spraw zdrowia danych oraz informacji, stanowiących wsparcie w procesie podejmowania decyzji refundacyjnych dla ww. świadczeń opieki zdrowotnej i zmniejsza obszar niepewności związanych z tymi decyzjami.
Misję tę Agencja realizuje od 2005 roku, wykonując zlecenia Ministra Zdrowia od 2008 r. w oparciu o ustawy:
- o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych oraz
- o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych.
Rys historyczny
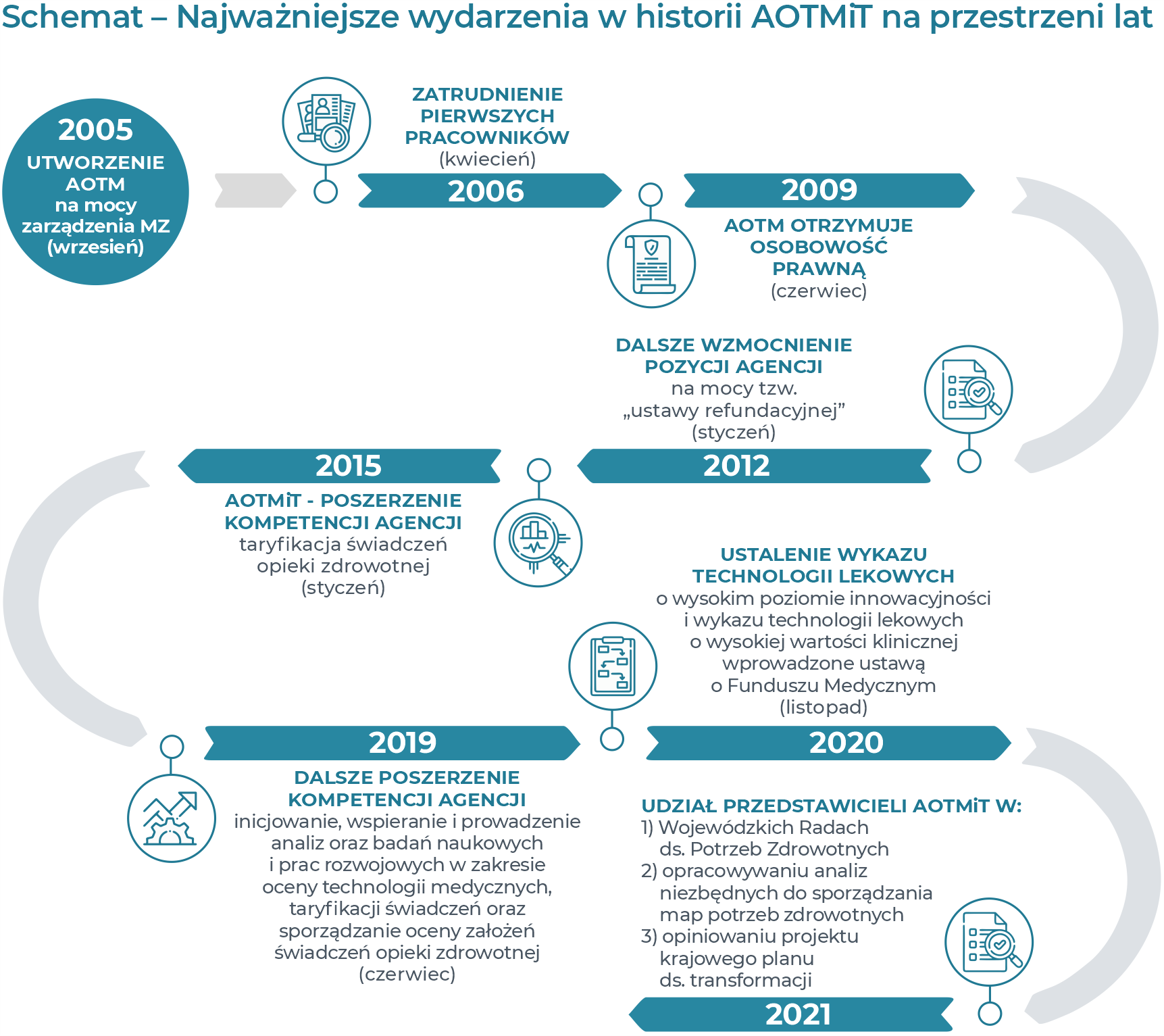
Agencja Oceny Technologii Medycznych została utworzona 16 września 2005 roku, na podstawie Zarządzenia Ministra Zdrowia z dnia 1 września 2005 roku w sprawie utworzenia Agencji Oceny Technologii Medycznych (Dz. Urz. MZ z 2005 r. Nr 13 poz. 56), jako państwowej jednostki budżetowej podległej ministrowi właściwemu do spraw zdrowia.
Zadaniem Agencji było dokonywanie oceny procedur medycznych, ze szczególnym uwzględnieniem procedur medycznych będących przedmiotem umów o udzielanie świadczeń opieki zdrowotnej.
Na mocy ustawy z dnia 25 czerwca 2009 roku o zmianie ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych oraz ustawy o cenach (Dz. U. z 2009 r. Nr 118, poz. 989) Agencja Oceny Technologii Medycznych uzyskała status państwowej jednostki organizacyjnej posiadającej osobowość prawną.
Na podstawie ustawy z dnia 22 lipca 2014 roku o zmianie ustawy o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych z dnia 1 stycznia 2015 roku, Agencja otrzymała kolejne zadania dotyczące taryfikacji świadczeń opieki zdrowotnej.
Nowelizacja ustawy wprowadziła zmianę nazwy Agencji Oceny Technologii Medycznych na Agencję Oceny Technologii Medycznych i Taryfikacji (AOTMiT). Zmianie uległa również struktura organizacyjna Agencji, która odzwierciedla dwie główne dziedziny działalności: ocenę technologii medycznych i wycenę świadczeń gwarantowanych.
W czerwcu 2019 r. w związku z nowelizacją ustawy o świadczeniach, Agencja otrzymała nowe zadanie ustawowe dotyczące inicjowania, wspierania i prowadzenia analiz oraz badań naukowych i prac rozwojowych w zakresie oceny technologii medycznych, taryfikacji świadczeń oraz sporządzania oceny założeń do realizacji świadczeń opieki zdrowotnej.
W drodze kolejnych nowelizacji aktów prawnych zakres zadań Agencji i jej uprawnienia uległy dalszemu poszerzeniu w ramach wskazanych wyżej dwóch obszarów.


- Rada Przejrzystości
- Elżbieta Lanc
- Dr n. med. Jacek Rubik
- Marcin Kołakowski
- Dr hab. n. med. Aleksandra Zasada
- Dr n. med. Anna Socha- Banasiak
- Prof. dr hab. n. med. Zbigniew Siudak
- Paweł Grzesiewski
- Prof. dr hab. n. med. Ewa Obuchowicz
- Prof. dr hab. Małgorzata Sznitowska
- Prof. dr hab. n. med. Tomasz Pasierski
- Marcin Lipowski
- Tomasz Młynarski
- Maciej Karaszewski
- Prof. dr hab. n. med. Roman Junik
- Katarzyna Galas
- Małgorzata Dziedziak
- Prof. dr hab. n. med. Andrzej Dąbrowski
- Dr hab. n. med. Anna Czerniecka- Kubicka
- Płk dr n. med. Artur Bachta
- Prof. dr hab. Małgorzata Bała
- Udział w posiedzeniach Rady Przejrzystości
- Plany pracy Rady Przejrzystości
- Zakres tematyczny posiedzeń Rady Przejrzystości
- Praca
- Kontakt
- O Agencji
- Rada do spraw Taryfikacji
- Struktura organizacyjna AOTMiT
*Szanowni Państwo,
niniejszym informujemy, iż zamieszczane na stronie Agencji materiały i wyniki dyskusji stanowią efekt pracy koncepcyjnej i procesu analitycznego przeprowadzonego przez zespół Agencji Oceny Technologii Medycznych i Taryfikacji w oparciu o paradygmat EBM, obejmujący: wyszukiwanie, selekcję, syntezę i interpretację dowodów naukowych, lub przeprowadzoną analizę danych.
W związku z powyższym, pragniemy przekazać, iż wykorzystywanie materiału analitycznego lub wyników dyskusji, zgodnie z dobrą praktyką, powinno być opatrzone informacją na temat źródła w postaci: [tytuł prezentacji/raportu], AOTMiT, Warszawa, czerwiec 2021 r.]

