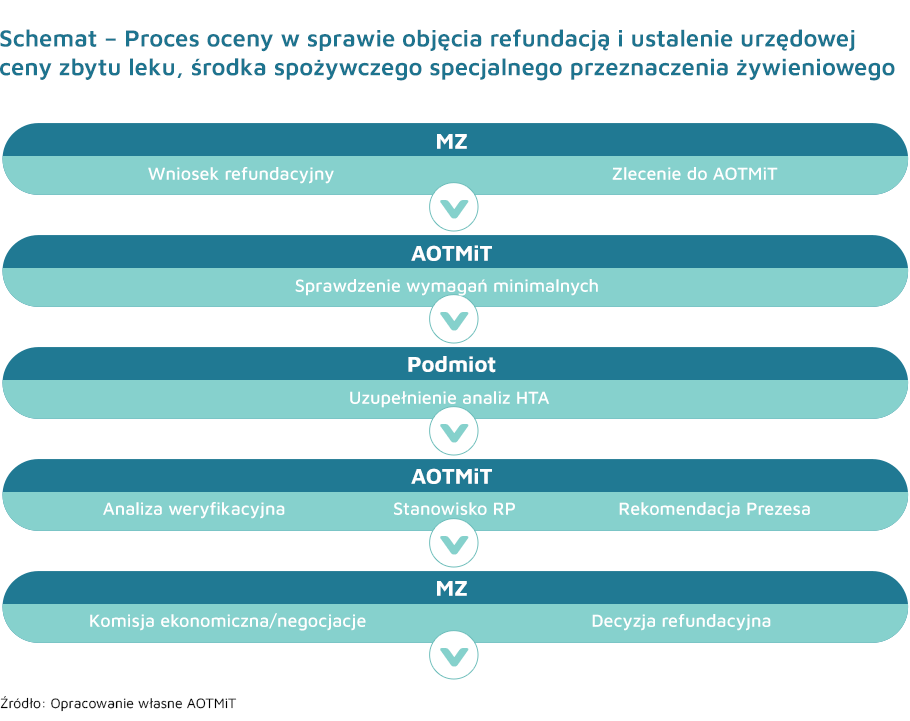
Umieszczenie leków, środków spożywczych specjalnego przeznaczenia żywieniowego (śsspż) oraz wyrobów medycznych na wykazach refundowanych do stosowania w zakresie wskazań rejestracyjnych, czy określenie/zmiana urzędowej ceny zbytu netto leku odbywa się na podstawie stosownego wniosku składanego do Ministerstwa Zdrowia przez przedstawiciela podmiotu odpowiedzialnego dla danej technologii medycznej.
Jednym z kryteriów, które Minister Zdrowia uwzględnia przy wydawaniu decyzji administracyjnej o objęciu refundacją i ustaleniu ceny zbytu netto jest rekomendacja Prezesa Agencji. Podstawą do wydania rekomendacji jest analiza weryfikacyjna Agencji załączonej do wniosku dokumentacji HTA, jak również stanowisko Rady Przejrzystości w przedmiotowej sprawie. Sposób i procedury przygotowania Analizy Weryfikacyjnej AOTMiT oraz wysokość opłaty za tę analizę określa Rozporządzenie Ministra Zdrowia z dnia 18 grudnia 2013 r. w sprawie sposobu i procedur przygotowania analizy weryfikacyjnej Agencji Oceny Technologii Medycznych i Taryfikacji oraz wysokości opłaty za tę analizę (Dz.U. 2023 poz. 545).
W ramach prowadzonej oceny Agencja:
- dokonuje sprawdzenia czy analizy dołączone do wniosku spełniają określone w Rozporządzeniu Ministra Zdrowia z dnia 24 października 2023 r. w sprawie minimalnych wymagań, jakie muszą spełniać analizy uwzględnione we wnioskach o objęcie refundacją i ustalenie ceny zbytu netto, o objęcie refundacją i ustalenie ceny zbytu netto technologii lekowej o wysokiej wartości klinicznej oraz o podwyższenie ceny zbytu netto leku, środka spożywczego specjalnego przeznaczenia żywieniowego i wyrobu medycznego, które nie mają odpowiednika refundowanego w danym wskazaniu (Dz.U. 2023 poz. 2345) minimalne wymagania, jakie muszą spełniać analizy uwzględnione we wnioskach o objęcie refundacją i ustalenie ceny zbytu netto oraz o podwyższenie urzędowej ceny zbytu leku, śsspż, wyrobu medycznego, które nie mają odpowiednika refundowanego w danym wskazaniu;
- przeprowadza ocenę załączonych do wniosku: analizy klinicznej, analizy ekonomicznej, analizy wpływu na budżet, a w określonych przypadkach analizy racjonalizacyjnej przeprowadzana poprzez:
– analizę piśmiennictwa naukowego, w szczególności wytycznych praktyki klinicznej oraz publikacji opisujących wyniki badań naukowych – w tym badań klinicznych, przeglądów systematycznych oraz analiz ekonomicznych,
– występowanie o opinię do ekspertów,
– analizę dokumentów określających warunki dopuszczenia do obrotu oraz sposób i poziom finansowania leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych,
– kwerendy w bazach bibliograficznych – w zakresie odpowiednim do przedmiotu oceny analiz,
– weryfikację poprawności obliczeń stanowiących podstawę oszacowań przedstawionych w ocenianych analizach, a w przypadku stwierdzenia ich niepoprawności – dokonanie własnych obliczeń w tym zakresie,
– identyfikację rozbieżności pomiędzy informacjami zawartymi w ocenianych analizach a stanem faktycznym na dzień złożenia wniosku;
- przeprowadza przegląd rekomendacji refundacyjnych, odnośnie do wnioskowanego leku, śsspż, wyrobu medycznego z innych państw, wraz z analizą ich uzasadnień i szczegółowych warunków objęcia refundacją;
- przeprowadza analizę szczegółowych warunków objęcia refundacją leku, śsspż, wyrobu medycznego w innych państwach, która odbywa się przez zestawienie informacji dotyczących: aktualnego poziomu refundacji w innych państwach;
- wyznacza wartość progowej ceny zbytu netto leku, ssspż, wyrobu medycznego, przy której koszt uzyskania dodatkowego roku życia skorygowanego o jakość (QALY), a w przypadku braku możliwości wyznaczenia tego kosztu – koszt uzyskania dodatkowego roku życia, jest równy wysokości progu, ustalonego w wysokości trzykrotności Produktu Krajowego Brutto na jednego mieszkańca.
Analiza Weryfikacyjna Agencji jest niezwłocznie przekazywana przez Prezesa Agencji Radzie Przejrzystości oraz wnioskodawcy, a następnie publikowana w Biuletynie Informacji Publicznej wraz z analizami wnioskodawcy. Do wszystkich ww. analiz można zgłaszać uwagi w terminie 7 dni od dnia opublikowania.
Prezes Agencji, na podstawie stanowiska Rady Przejrzystości w sprawie oceny leku, śsspż, wyrobu medycznego, przygotowuje rekomendację w zakresie zasadności lub niezasadności objęcia refundacją danego leku, śsspż, wyrobu medycznego.
Rekomendacja jest przekazywana przez Prezesa Agencji Ministrowi Zdrowia w terminie nie dłuższym niż 60 dni od dnia otrzymania wniosku o objęcie refundacją i ustalenie ceny zbytu netto lub podwyższenie ceny zbytu netto leku, śsspż, wyrobu medycznego, chyba, że załączone do wniosku analizy nie spełniają wymagań minimalnych. W przypadku stwierdzenia, że analizy dołączone do wniosku nie spełniają wymagań określonych w Rozporządzeniu Ministra Zdrowia z dnia 24 października 2023 r. r. w sprawie minimalnych wymagań, jakie muszą spełniać analizy uwzględnione we wnioskach o objęcie refundacją i ustalenie ceny zbytu netto, o objęcie refundacją i ustalenie ceny zbytu netto technologii lekowej o wysokiej wartości klinicznej oraz o podwyższenie ceny zbytu netto leku, środka spożywczego specjalnego przeznaczenia żywieniowego i wyrobu medycznego, które nie mają odpowiednika refundowanego w danym wskazaniu (Dz.U. 2023 poz. 2345), Prezes Agencji wzywa wnioskodawcę za pomocą Systemu Obsługi List Refundacyjnych do uzupełnienia analiz, wyznaczając mu termin nie krótszy niż 21 dni na uzupełnienie dokumentacji, a bieg terminów ulega zawieszeniu.
W przypadku gdy Prezes Agencji stwierdzi, że w związku z utworzeniem opisu programu lekowego przez Ministra Zdrowia na podstawie art. 16a ust.1 i 2 ustawy z dnia 12 maja 2011 r. o refundacji leków1), środków2) spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz. U. z 2024 r. poz. 930 z późn. zm.) nastąpiła zmiana populacji docelowej, Prezes Agencji wzywa wnioskodawcę do uzupełnienia analiz, dołączonych do wniosku , za pomocą Systemu Obsługi List Refundacyjnych. Bieg terminów ulega zawieszeniu do dnia uzupełnienia dokumentacji.
Analiza Weryfikacyjna Agencji jest przekazywana Komisji Ekonomicznej przez Ministra Zdrowia wraz z ww. wnioskiem, stanowiskiem Rady Przejrzystości, rekomendacją Prezesa Agencji i innymi dokumentami, na podstawie których przygotowana została rekomendacja, celem przeprowadzenia negocjacji warunków objęcia refundacją.
*Szanowni Państwo,
niniejszym informujemy, iż zamieszczane na stronie Agencji materiały i wyniki dyskusji stanowią efekt pracy koncepcyjnej i procesu analitycznego przeprowadzonego przez zespół Agencji Oceny Technologii Medycznych i Taryfikacji w oparciu o paradygmat EBM, obejmujący: wyszukiwanie, selekcję, syntezę i interpretację dowodów naukowych, lub przeprowadzoną analizę danych.
W związku z powyższym, pragniemy przekazać, iż wykorzystywanie materiału analitycznego lub wyników dyskusji, zgodnie z dobrą praktyką, powinno być opatrzone informacją na temat źródła w postaci: [tytuł prezentacji/raportu], AOTMiT, Warszawa, czerwiec 2021 r.]

