Tworzenie wykazu technologii lekowych o wysokim poziomie innowacyjności (TLI) dalej jako „wykaz TLI” jest rozwiązaniem systemowym, którego celem jest wsparcie działań zmierzających do poprawy zdrowia i jakości życia w Polsce. Mechanizm ten funkcjonuje w ramach Funduszu Medycznego, który powstał z inicjatywy Prezydenta RP, we współpracy z Ministrem Zdrowia (MZ). Podkreślenia wymaga, iż FM to odpowiedź na potrzeby zdrowotne pacjentów dotyczące zarówno profilaktyki i diagnostyki a także w istotnym zakresie leczenia.
FM w ramach jednego z mechanizmów określonych przepisami ustawy z dnia 7 października 2020 r. o Funduszu Medycznym (Dz. U. poz. 1875) przewiduje umożliwienie pacjentom dostępu do najnowszych terapii lekowych poprzez finansowanie:
- leków w ramach ratunkowego dostępu do technologii lekowych, o którym mowa w ustawie z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych;
- technologii lekowej o wysokiej wartości klinicznej;
- technologii lekowej o wysokim poziomie innowacyjności, których dotyczy niniejszy komunikat.
Nowa ścieżka dostępu do innowacyjnych technologii lekowych (TLI) opiera się przede wszystkim na działaniach podejmowanych przez Agencję Oceny Technologii Medycznych i Taryfikacji, dalej jako „Agencja”, która raz w roku przygotowuje dla Ministra Zdrowia wykaz TLI. Agencja ustala poziom innowacyjności oraz warunki tworzenia tego wykazu z uwzględnieniem w szczególności oczekiwanych efektów zdrowotnych, biorąc pod uwagę m.in. siłę interwencji, jakość danych naukowych, niezaspokojoną potrzebę zdrowotną, wielkość populacji docelowej oraz priorytety zdrowotne. Zakres tych danych jest niezwykle istotny ponieważ leki o wysokim poziomie innowacyjności, które miałyby podlegać finansowaniu, są stosunkowo krótko dostępne na rynku, a to wiąże się z dużą niepewnością wnioskowania.
Warto podkreślić, że technologie lekowe o wysokim poziomie innowacyjności skupiają się na chorobach rzadkich i onkologicznych, a utworzenie wykazu TLI, koncentruje się na obiecujących terapiach oferowanych dla tych schorzeń.
Utworzenie wykazu TLI to pierwszy etap procesu refundacyjnego dla technologii lekowych o wysokim poziomie innowacyjności. Kolejnym jest utworzenie przez Ministra Zdrowia listy TLI po wcześniejszym zasięgnięciu opinii Rady Przejrzystości, Konsultantów Krajowych oraz Rzecznika Praw Pacjenta. Umieszczenie technologii na liście TLI Ministra Zdrowia umożliwia przejście do następnego etapu, czyli składania zgodnie z art. 24 ust. 1 pkt 1b ustawy o refundacji wniosków o objęcie danej technologii refundacją.
Innowacyjna technologia lekowa zostaje objęta refundacją tylko wówczas, gdy wniosek przejdzie pozytywnie całą procedurę określoną w przepisach ustawy o refundacji.
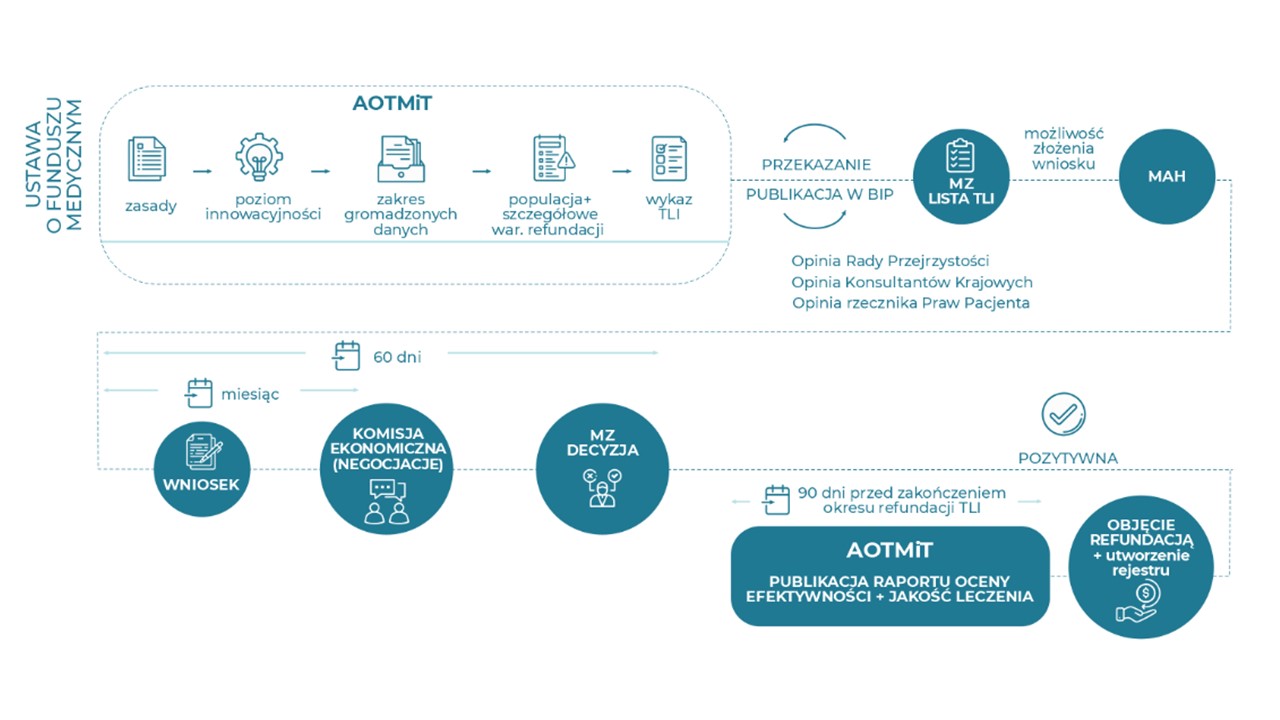 Wykres 1. Przebieg procesu refundacyjnego dla technologii lekowych o wysokim poziomie innowacyjności
Wykres 1. Przebieg procesu refundacyjnego dla technologii lekowych o wysokim poziomie innowacyjności
Zgodnie z brzmieniem art. 40a ust. 4 ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych[1] (ustawa o refundacji), Agencja Oceny Technologii Medycznych i Taryfikacji (Agencja), w ramach prac nad kolejnym wykazem technologii lekowych o wysokim poziomie innowacyjności (wykaz TLI), przeprowadziła ocenę oczekiwanych efektów zdrowotnych kierując się m.in.:
- siłą analizowanej interwencji,
- jakością danych naukowych,
- niezaspokojoną potrzebą zdrowotną,
- wielkością populacji docelowej,
- priorytetami zdrowotnymi.
Proces tworzenia wykazu TLI składa się z następujących etapów:
- identyfikacja technologii lekowych do szczegółowej oceny,
- analiza zgodnie z wiedzą z zakresu HTA,
- przygotowanie i publikacja wykazu TLI.
Ocenie zostały poddane leki, dla których decyzja o pozwoleniu na dopuszczenie do obrotu w procedurze centralnej w Unii Europejskiej (UE) została wydana od 27 listopada 2021 r. do dnia 31 grudnia 2022 r., dla których decyzje o dopuszczeniu do obrotu zostały opublikowane do dnia 02.01.2023 r.). Według zestawienia Europejskiej Agencji Leków (European Medicines Agency, EMA) w ww. okresie dopuszczono do obrotu na terenie UE 103 produkty lecznicze.
Z procesu wykluczono leki, które uzyskały pozwolenie na dopuszczenie do obrotu na podstawie dokumentacji biorównoważności lub biopodobności. Pozostałe 76 technologii lekowych to leki oryginalne.
Spośród 76 leków oryginalnych, które zakwalifikowano do dalszej selekcji, ocenie poddano produkty, dla których decyzja o pozwoleniu na dopuszczenie do obrotu obejmuje zastosowanie w onkologii lub w chorobach rzadkich oraz dla których do dnia opublikowania wykazu TLI nie został złożony wniosek o objęcie refundacją i ustalenie urzędowej ceny zbytu.
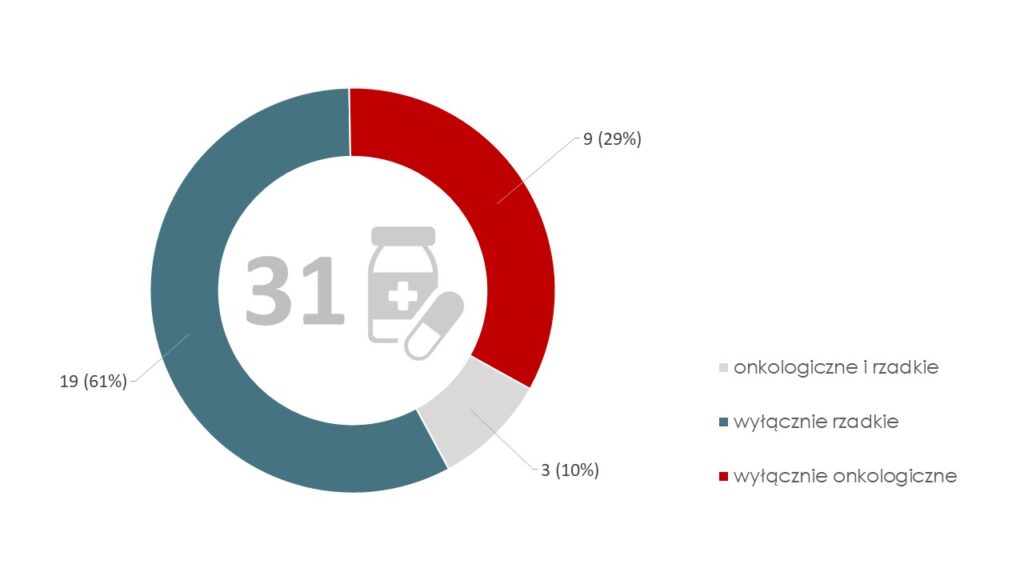
Łącznie kryteria selekcji do oceny spełniły 31 produktów leczniczych, z czego większość to leki ze wskazaniem w chorobach rzadkich (ok. 64%). Część leków to produkty zarejestrowane w chorobie onkologicznej z jednoczesnym statusem leku sierocego (ang. orphan) (ok. 10%).
Wykres 2. Produkty lecznicze spełniające łącznie wszystkie kryteria selekcji do oceny, w podziale leki stosowane w chorobach onkologicznych i rzadkich
Spośród produktów spełniających łącznie wszystkie kryteria selekcji, jeden lek miał więcej niż jedno wskazanie do oceny i został oceniony odrębnie w każdym z trzech zarejestrowanych wskazań. W konsekwencji oceniono 33 technologie lekowe.
Wykres 3. Technologie lekowe spełniające łącznie wszystkie kryteria selekcji do oceny, w podziale na leki stosowane w chorobach onkologicznych i rzadkich 
Poniżej, zgodnie z Międzynarodową Klasyfikacją Chorób (ang. International Classification of Diseases and Related Health Problems) ICD-10 oraz klasyfikacją anatomiczno‑terapeutyczno-chemiczną (ATC, ang. Anatomical Therapeutic Chemical Classification System), przedstawiono spektrum schorzeń objętych przez wspomniane technologie.
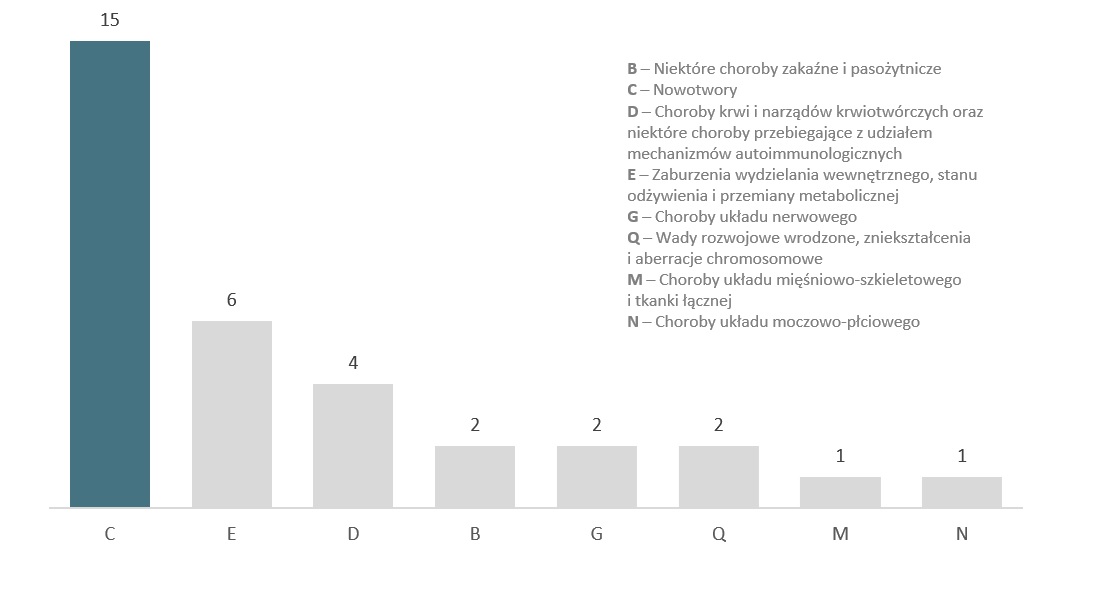
Kody dla chorób nowotworowych obejmowały prawie połowę ocenianych technologii lekowych, drugą grupę stanowiły zaburzenia wydzielania wewnętrznego, stanu odżywienia i przemiany metabolicznej (łącznie 15 technologii stosowanych w chorobach onkologicznych vs sumarycznie 18 w pozostałych).
Wykres 4. Podział ocenianych technologii lekowych według ICD-10
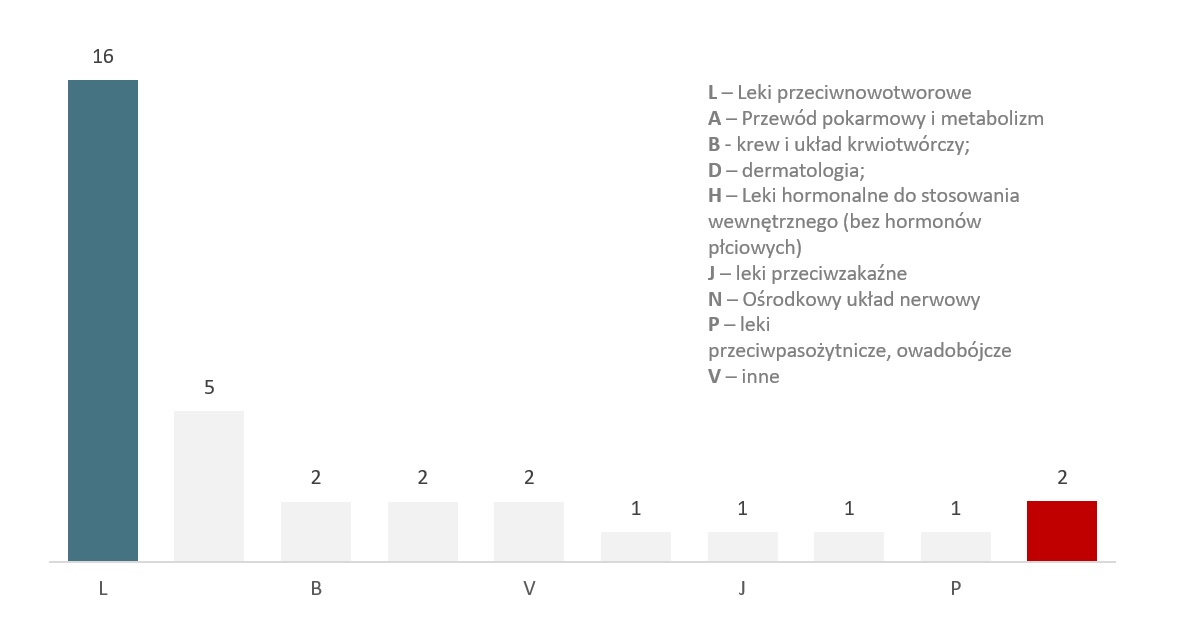
Do grupy leków przeciwnowotworowych i immunomodulujących zaliczono najwięcej technologii (16). W innych grupach anatomicznych znajdowało się sumarycznie 15 terapii, natomiast w przypadku 2 nie określono dotychczas kodu ATC.
Wykres 5. Podział ocenianych technologii lekowych według ATC
W trakcie oceny zwracano szczególną uwagę na jakość dostępnych dowodów naukowych, która wiąże się z wiarygodnością analizowanych wyników oraz wpływa na (nie)pewność wnioskowania. A także oceniano efekty zdrowotne terapii mając na względzie czy punkty końcowe są pierwszorzędowymi czy zastępczymi punktami końcowymi, a także czy różnica wielkości efektu zdrowotnego między interwencją a komparatorem jest znacząca.
Zgodnie z przeprowadzoną analizą, część z ocenianych technologii nie ma finansowanej w ocenianych wskazaniach alternatywnej technologii, co można potraktować jako istnienie niezaspokojonej potrzeby medycznej, choć należy także podkreślić, że sama dostępność technologii w danym wskazaniu nie jest jednoznaczna z zaspokojeniem potrzeb zdrowotnych w danej jednostce chorobowej.
Na podstawie przeprowadzonej oceny technologii lekowych z uwzględnieniem kryteriów ustawowych, utworzono wykaz TLI, który uwzględnia 8 technologii lekowych.
|
Nazwa leku |
Substancja czynna | Oceniane wskazanie |
| Artesunate Amivas | artezunat | do stosowania w leczeniu początkowym ciężkiej malarii u osób dorosłych i dzieci |
| Kimmtrak | tebentafusp | w monoterapii w leczeniu dorosłych pacjentów, u których występuje ludzki antygen leukocytarny (HLA)-A*02:01, z nieresekcyjnym lub przerzutowym czerniakiem błony naczyniowej oka |
| Nulibry | fosdenopteryna | leczenie pacjentów z niedoborem kofaktora molibdenowego typu A |
| Oxbryta | wokselotor | w leczeniu niedokrwistości hemolitycznej spowodowanej niedokrwistością sierpowatokrwinkową (ang. sickle cell disease, SCD) u dorosłych i dzieci w wieku 12 lat i starszych w monoterapii lub w skojarzeniu z hydroksymocznikiem |
| Padcev | enfortumab vedotin | monoterapia raka urotelialnego miejscowo zaawansowanego lub z przerzutami u dorosłych pacjentów, którzy otrzymali wcześniej chemioterapię opartą na pochodnych platyny i inhibitor receptora programowanej śmierci komórki 1 lub inhibitor ligandu programowanej śmierci komórki 1 |
| Vyvgart | efgartigimod alfa | leczenie uzupełniające do standardowej terapii dorosłych pacjentów z uogólnioną miastenią rzekomoporaźną (gMG), u których stwierdzono obecność przeciwciał przeciwko receptorowi acetylocholiny (AChR) |
| Xenpozyme | olipudaza alfa | u dzieci i młodzieży oraz dorosłych jako enzymatyczna terapia zastępcza w leczeniu objawów niedoboru kwaśnej sfingomielinazy (ang. Acid Sphingomyelinase Deficiency, ASMD) typu A/B lub B, niezwiązanych z ośrodkowym układem nerwowym (OUN) |
| Zokinvy | lonafarnib | leczenie pacjentów w wieku 12 miesięcy i starszych z genetycznie potwierdzonym rozpoznaniem zespołu progerii Hutchinsona-Gilforda lub progeroidowej laminopatii z wadliwą obróbką prelamin (ang. processing deficient progeroid laminopathy), które są związane z heterozygotyczną mutacją genu LMNA z gromadzeniem białka podobnego do progeryny lub z homozygotyczną albo złożoną heterozygotyczną mutacją genu ZMPSTE24 |
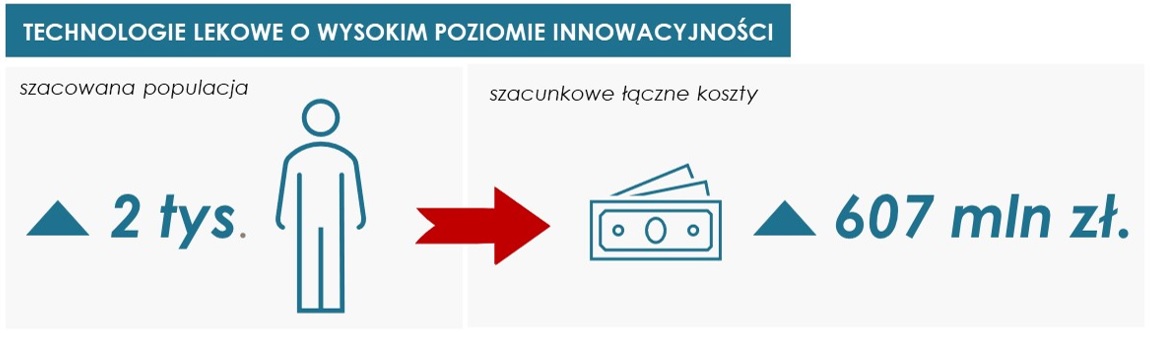
Szacuje się, że wyżej wskazane technologie lekowe o wysokim poziomie innowacyjności mogą być zastosowane w populacji około 2 tys. pacjentów, a szacunkowe łączne koszty mogą wynieść ponad 607 mln zł.
[1] Dz. U. z 2022 r. poz. 2555 z późn. zm.