Agencja Oceny Technologii Medycznych i Taryfikacji zakończyła prace związane z utworzeniem wykazu technologii lekowych o wysokim poziomie innowacyjności, który opublikowano w dniu 25 lutego 2022 r. w Biuletynie Informacji Publicznej.
Prace nad niniejszym wykazem zostały rozpoczęte we wrześniu 2021 r., uczestniczył w nich zespół 40 analityków Agencji. Pracami zespołu kierowali doświadczeni koordynatorzy. Prace zespołu były prowadzone pod bezpośrednim nadzorem Prezesa Agencji oraz dyrektorów wydziałów analitycznych. Kwestie metodyki były konsultowane z ekspertami Rady Przejrzystości.
W toku prac przygotowano:
- wykaz TLI,
- szczegółowe zasady tworzenia wykazu technologii lekowych o wysokiej innowacyjności wraz z określeniem oczekiwanych korzyści zdrowotnych oraz wskaźników oceny efektywności terapii,
- 27 opracowań analitycznych,
uwzględniając wiedzę z zakresu oceny technologii medycznych (HTA), w szczególności ocenę oczekiwanych efektów zdrowotnych, biorąc pod uwagę siłę interwencji, jakość danych naukowych, niezaspokojoną potrzebę zdrowotną, wielkość populacji docelowej oraz priorytety zdrowotne.
Proces tworzenia wykazu TLI składał się z następujących etapów:
- Identyfikacja technologii lekowych do szczegółowej oceny.
- Analiza zgodnie z wiedzą z zakresu HTA.
- Opiniowanie przez Radę Przejrzystości.
- Przygotowanie i publikacja wykazu TLI.
Podstawą do oceny było zestawienie Europejskiej Agencji Leków (European, Medicines Agency, EMA) o zarejestrowanych w EMA i dopuszczonych do obrotu na terenie Unii Europejskiej (UE) produktach leczniczych w okresie 27.11.2020-26.11.2021 wg. stanu na dzień 31.12.2021 r.
W tym czasie zostało zarejestrowanych przez EMA łącznie 89 leków stosowanych u ludzi, z czego aktualnie dopuszczonych do obrotu pozostaje 87 (2 utraciły ważność pozwolenia na dopuszczenie do obrotu). Uwzględniając precyzyjnie wskazania dla poszczególnych produktów leczniczych, szczegółową oceną objęto 27 technologii lekowych.
Wykres 1. Technologie lekowe włączone do oceny w podziale na wskazania dotyczące chorób onkologicznych i rzadkich
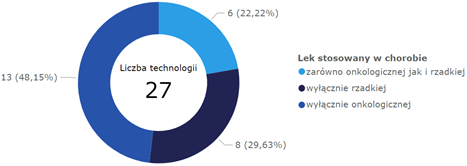
Oceniany zakres wskazań oraz produktów leczniczych był różnorodny. Najwięcej technologii (20) zalicza się do leków przeciwnowotworowych i immunomodulujących. W innych grupach anatomicznych znajdowało się sumarycznie 7 terapii.
Wykres 2. Technologie lekowe oceniane do wykazu TLI w podziale na grupy ATC

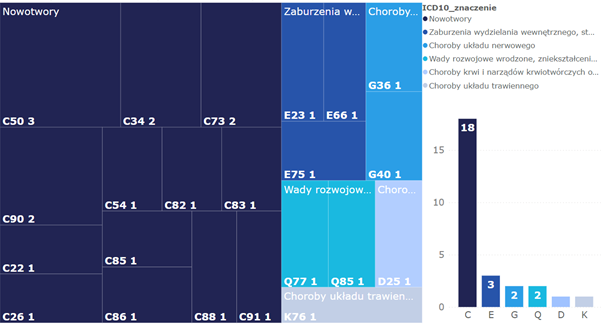
Natomiast w analizie wskazań przypisanych do poszczególnych grup rozpoznań wg ICD-10 kody dla chorób nowotworowych obejmowały najwięcej technologii, pozostałe grupy były mniej liczne (łącznie 18 technologii stosowanych w chorobach onkologicznych vs sumarycznie 9 w pozostałych).
Wykres 3. Technologie lekowe oceniane do wykazu TLK w podziale na rozpoznanie ICD-10
Zgodnie z przyjętą metodologią dla poszczególnych technologii medycznych dokonano oceny:
- niezaspokojonej potrzeby zdrowotnej,
- populacji docelowej,
- jakości dowodów naukowych,
- siły interwencji,
- ekonomicznej,
- niepewności wnioskowania.
Technologie lekowe o wysokiej innowacyjności zostały wyłonione przez ekspertów Rady Przejrzystości, którzy na posiedzeniach Rady w pełnym składzie przeprowadzili szczegółową ocenę oraz dyskusję poszczególnych technologii lekowych przy uwzględnieniu materiałów analitycznych.
W oparciu o przyjętą metodykę i biorąc pod uwagę opinię Rady Przejrzystości utworzono wykaz TLI (udostępniony w Biuletynie Informacji Publicznej Agencji).
W wykazie TLI z dnia 25 lutego 2022 r. ujęto 21 technologii lekowych:
- Abecma (idekabtagen wikleucel) – nawrotowy i oporny na leczenie szpiczak mnogi, w leczeniu dorosłych pacjentów, u których stosowano wcześniej co najmniej trzy metody leczenia, w tym lek immunomodulujący, inhibitor proteasomu i przeciwciało anty‑CD38, i wykazano progresję choroby podczas ostatnio stosowanego leczenia.
- Brukinsa (zanubrutynib) – makroglobulinemia Waldenströma, u dorosłych pacjentów, którzy wcześniej stosowali co najmniej jedną metodę leczenia, albo w leczeniu pierwszego rzutu u pacjentów, którzy nie kwalifikują się do stosowania chemioimmunoterapii.
- Bylvay (odewiksybat) – postępująca rodzinna cholestaza wewnątrzwątrobowa (ang. progressive familial intrahepatic cholestasis, PFIC) u pacjentów w wieku od 6 miesięcy.
- Enhertu (trastuzumab derukstekan) – HER2-dodatni raki piersi, nieoperacyjny lub przerzutowy, monoterapia dorosłych pacjentów, którzy otrzymali dwa lub więcej schematów leczenia opartych na anty-HER2.
- Enspryng (satralizumab) – choroby ze spektrum zapalenia nerwów wzrokowych oraz rdzenia kręgowego (zespół Devic’a), monoterapia lub w skojarzenie z terapią immunosupresyjną u pacjentów dorosłych i młodzieży w wieku powyżej 12 lat, u których występują przeciwciała IgG przeciwko akwaporynie-4 (AQP4-IgG).
- Fintepla (fenfluramina (fenfluraminy chlorowodorek)) – napady padaczkowe związane z zespołem Dravet, jako dodatek do leczenia innymi lekami przeciwpadaczkowymi u pacjentów w wieku od 2 lat.
- Gavreto (pralsetynib) – RET-dodatni (ang. Rearranged During Transfection, RET) zaawansowany niedrobnokomórkowy rak płuca (NDRP), w monoterapii u pacjentów dorosłych nieleczonych wcześniej inhibitorem RET.
- Imcivree (setmelanotyd) – otyłość i kontrola uczucia głodu towarzyszącego potwierdzonemu w badaniach genetycznych związanemu z bialleliczną utratą funkcji niedoborowi roopiomelanokortyny (POMC), w tym PCSK1, lub receptora leptyny (LEPR) u osób dorosłych i dzieci w wieku od 6 lat.
- Jemperli (dostarlimab) – nawrotowy lub zaawansowany rak endometrium z upośledzeniem naprawy nieprawidłowo sparowanych nukleotydów (ang. mismatch repair deficient, MMR)/wysoką niestabilnością mikrosatelitarną (ang. microsatellite instability-high, MSI-H), który uległ progresji w trakcie lub po zakończeniu wcześniejszego schematu leczenia zawierającego platynę, w monoterapii w leczeniu dorosłych pacjentek.
- Koselugo (selumetynib) – leczenie objawowych, nieoperacyjnych nerwiakowłókniaków splotowatych (ang. plexiform neurofibromas, PN) u dzieci i młodzieży w wieku 3 lat i starszych z neurofibromatozą typu 1 (NF1).
- Libmeldy (atidarsagen autotemcel) – leukodystrofia metachromatyczna (ang. metachromatic leukodystrophy, MLD) odznaczająca się dwuallelowymi mutacjami genu arylosulfatazy A prowadzącymi do zmniejszenia aktywności enzymatycznej ARSA, w przypadku: – dzieci z późnymi niemowlęcymi albo wczesnymi młodzieńczymi postaciami choroby, bez objawów klinicznych choroby; – dzieci z wczesną młodzieńczą postacią choroby, z wczesnymi objawami klinicznymi choroby, mogące nadal poruszać się samodzielnie, przed pojawieniem się zaburzenia funkcji poznawczych.
- Minjuvi (tafasytamab) – nawrotowa albo oporna na leczenie postać chłoniaka nieziarniczego rozlanego z dużych komórek B (diffuse large B-cell lymphoma, DLBCL), w skojarzeniu z lenalidomidem, a następnie w monoterapii w leczeniu pacjentów dorosłych, którzy nie kwalifikują się do autologicznego przeszczepu komórek macierzystych (autologous stem cell transplant, ASCT).
- Nexpovio (selineksor) – szpiczak mnogi, w skojarzeniu z deksametazonem u dorosłych, u których wcześniej zastosowano co najmniej cztery metody leczenia i u których choroba okazała się oporna na leczenie co najmniej dwoma inhibitorami proteasomu, dwoma środkami immunomodulującymi oraz przeciwciałem monoklonalnym przeciwko CD38 i którzy wykazywali progresję choroby na ostatniej terapii.
- Pemazyre (pemigatynib) – miejscowo zaawansowany albo przerzutowy rak dróg żółciowych z fuzją albo rearanżacją receptora czynnika wzrostu fibroblastów 2 (fibroblast growth factor receptor 2, FGFR2), w monoterapii, w leczeniu osób dorosłych u których wystąpiła progresja choroby po przynajmniej jednej wcześniejszej linii leczenia ogólnoustrojowego.
- Retsevmo (selperkatynib) – zaawansowany rak rdzeniasty tarczycy (RRT) z mutacją w genie RET, w monoterapii, u dorosłych i młodzieży w wieku co najmniej 12 lat, którzy wymagają terapii systemowej po wcześniejszym leczeniu kabozantynibem i (lub) wandetanibem.
- Retsevmo (selperkatynib) – zaawansowany rak tarczycy z obecnością fuzji genu RET, u dorosłych, którzy wymagają terapii systemowej po wcześniejszym leczeniu sorafenibem i (lub) lenwatynibem.
- Retsevmo (selperkatynib) – zaawansowany, niedrobnokomórkowy rak płuca (NDRP) z obecnością fuzji genu RET, w monoterapii, u dorosłych, którzy wymagają terapii systemowej po wcześniejszej immunoterapii i (lub) chemioterapii opartej na związkach platyny.
- Tecartus (autologiczne transdukowane anty-CD19 komórki CD3-dodatnie)) – nawrotowy lub oporny na leczenie chłoniak z komórek płaszcza (ang. mantle cell lymphoma, MCL) u dorosłych pacjentów, którzy uprzednio otrzymali co najmniej dwie linie leczenia systemowego, w tym inhibitor kinazy tyrozynowej Brutona (ang. Bruton’s tyrosine kinase, BTK).
- Trodelvy (sacytuzumab gowitekan) – nieresekcyjny lub przerzutowy potrójnie ujemny rak piersi (ang. metastatic triple-negative breast cancer, mTNBC), w monoterapii, u dorosłych pacjentów, którzy wcześniej otrzymali co najmniej dwie linie leczenia systemowego, w tym co najmniej jedną w zaawansowanej chorobie.
- Tukysa (tukatynib) – HER2-dodatni miejscowo zaawansowany rak piersi lub HER2-dodatni rak piersi z przerzutami, w skojarzeniu z trastuzumabem i kapecytabiną u dorosłych pacjentów, którzy otrzymali co najmniej 2 schematy leczenia skierowanego przeciwko receptorowi HER2 w przeszłości.
- Voxzogo (wosorytyd) – achondroplazja u pacjentów w wieku co najmniej 2 lat, których nasady kości długiej nie są zamknięte.
Szacuje się, że leczenie poszczególnymi lekami dotyczy ponad 5 tysięcy pacjentów (nie sumowano populacji w tych samych wskazaniach). Szczegółowe oszacowanie populacji pacjentów w poszczególnych wskazaniach przedstawiono na wykresie poniżej.
Wykres 4. Oszacowanie populacji pacjentów dla poszczególnych technologii lekowych ujętych w wykazie


