Agencja Oceny Technologii Medycznych i Taryfikacji, zwana dalej „Agencją” zakończyła prace związane z utworzeniem wykazu technologii lekowych o wysokiej wartości klinicznej. W dniu 26 sierpnia 2021 r. przekazano ww. wykaz Ministrowi Zdrowia i w oparciu o ustawę z dnia 27 sierpnia 2004 r. o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych (Dz. U. z 2021 r. poz. 1285, z późn. zm.) opublikowano ww. wykaz w Biuletynie Informacji Publicznej.
Prace nad niniejszym wykazem zostały rozpoczęte z dniem 26 listopada 2020 r., tj. z dniem wejścia w życie ustawy o Funduszu Medycznym i do momentu publikacji wykazu, w pracach nad jego utworzeniem uczestniczyło 30 analityków Agencji.
Pracami zespołu kierowało dwóch doświadczonych koordynatorów. Prace zespołu były prowadzone pod bezpośrednim nadzorem Prezesa Agencji oraz dyrektorów wydziałów analitycznych. Kwestie metodyki były konsultowane z ekspertami Rady Przejrzystości. Prowadzone były dyskusje założeń także z Ministerstwem Zdrowia i Radą Funduszu Medycznego.
W toku prac przygotowano
- wykaz TLK,
- szczegółowe zasady stosowania technologii lekowych o wysokiej wartości klinicznej wraz z określeniem oczekiwanych korzyści zdrowotnych oraz wskaźniki oceny efektywności terapii,
- opracowania analityczne w formacie raportów, które dostępne są także w aplikacji.
Całość zebranego materiału analitycznego jest dostępna w aplikacji dedykowanej ocenie technologii lekowych o wysokiej wartości klinicznej https://tlk.aotm.gov.pl/#/

Przebieg prac
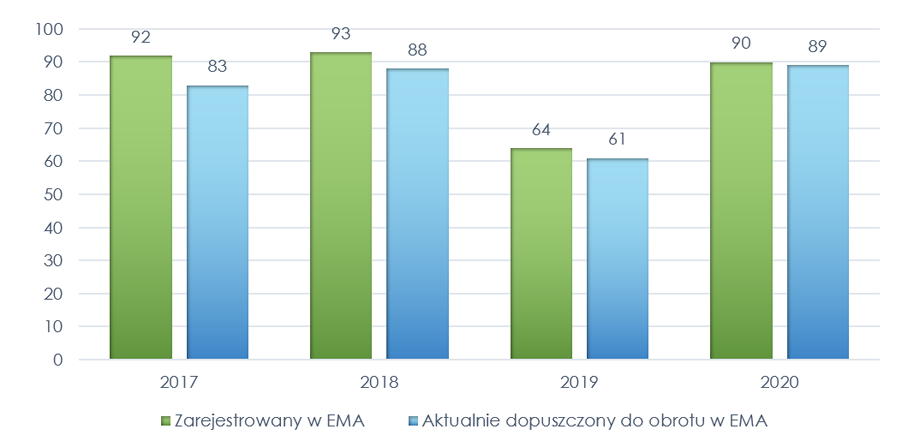
Podstawą do oceny było zestawienie Europejskiej Agencji Leków (European, Medicines Agency, EMA) o zarejestrowanych w EMA i dopuszczonych do obrotu na terenie Unii Europejskiej (UE) w latach 1995-2021 produktach leczniczych. W tym czasie zostało zarejestrowanych w EMA łącznie 1509 leków, z czego aktualnie dopuszczonych do obrotu pozostaje 1235 (274 utraciło ważność pozwolenia na dopuszczenie do obrotu).
Wykres 1. Produkty lecznicze zarejestrowane w EMA w latach 1995-2021 i aktualnie dopuszczone do obrotu

W latach 2017-2020 zarejestrowano w EMA 339 produktów leczniczych, z czego 321 posiadało ważne pozwolenie na dopuszczenie do obrotu na dzień 23 sierpnia 2021 r.
Wykres 2. Produkty lecznicze zarejestrowane w EMA i dopuszczone do obrotu na terenie UE w latach 2017-2020
W procesie tworzenia wykazu TLK określono technologie lekowe, czyli przypisano określone substancje czynne do precyzyjnie określonych wskazań. W tym celu przeanalizowano 321 produktów leczniczych mających ważne pozwolenie na dopuszczenie do obrotu na terenie UE i dla nich zdefiniowano 951 technologii lekowych (cząsteczko-wskazań), które kwalifikowały się do podstawowej oceny zgodności z wymogami ustawowymi.
Szczegółowo definiowano także populację docelową (wskazania), gdyż brano pod uwagę szczegółową informację o jednostce chorobowej, stopniu zaawansowania choroby, zastosowanych linii leczenia, stosowaniu terapii skojarzonych oraz wieku populacji docelowej. Dzięki temu wskazania zostały precyzyjnie określone w odniesieniu do każdego ocenianego produktu leczniczego.
Technologie lekowe do szczegółowej oceny
Dokonano analizy refundowanych wskazań, na podstawie której ustalono, że spośród powyższych, 951 technologii lekowych, 577 technologii lekowych jest objętych finansowaniem ze środków publicznych (pod uwagę wzięto finansowanie w ramach wykazów refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych, „Narodowego programu leczenia chorych na hemofilię i pokrewne skazy krwotoczne na lata 2019–2023”, programu polityki zdrowotnej „Leczenie antyretrowirusowe osób żyjących z wirusem HIV w Polsce na lata 2017–2021”, Narodowego Programu Szczepień przeciw COVID-19, Programu Szczepień Ochronnych (PSO) oraz technologie lekowe ocenione w procesie tworzenia wykazu technologii lekowych o wysokim poziomie innowacyjności).
Schemat 1. Schemat selekcji technologii lekowych do oceny
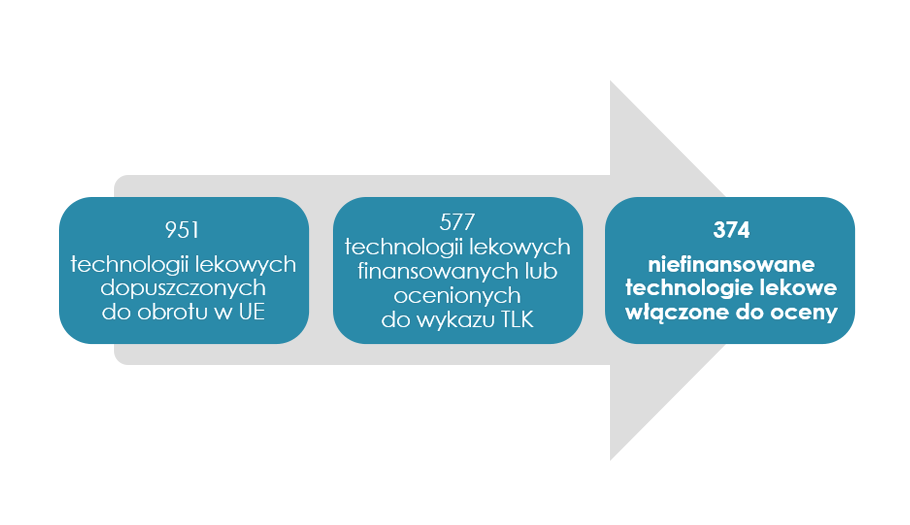
Przy uwzględnieniu powyższych warunków czasowych oraz finansowych do oceny włączono 374 technologie lekowe.
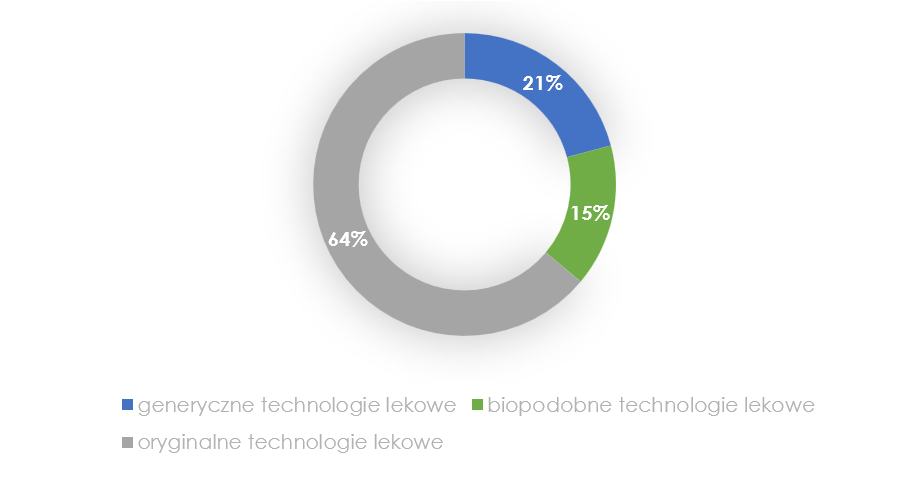
Spośród 374 technologii lekowych włączonych do oceny, zidentyfikowano:
- 239 oryginalnych technologii lekowych
- 78 generycznych technologii lekowych
- 57 biopodobnych technologii lekowych
Schemat 2. Oceniane technologie lekowe
Zróżnicowana grupa technologii lekowych
Oceniany zakres wskazań oraz produktów leczniczych był bardzo różnorodny. W procesie oceny uwzględniono leki z wszystkich grupy ATC z wyjątkiem grupy ATC P.
Wykres 3. Technologie lekowe oceniane do wykazu TLK w podziale na grupy ATC
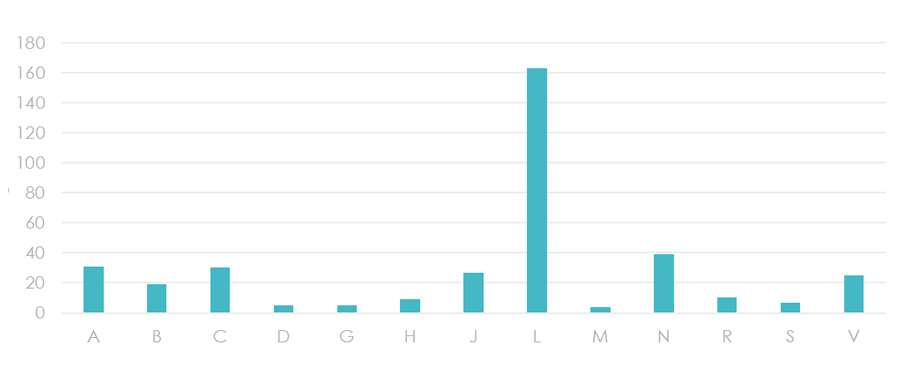
Natomiast analiza wskazań przypisanych do poszczególnych grup rozpoznań wg ICD-10 uwidoczniła, że w znacznej mierze dopuszczone do obrotu technologie lekowe stosuje się w chorobach onkologicznych, metabolicznych oraz chorobach układowych.
Wykres 4. Technologie lekowe oceniane do wykazu TLK w podziale na rozpoznanie ICD-10

Biorąc pod uwagę różnorodność technologii lekowych ocenianych w tym procesie, zwracano szczególną uwagę na dostępność i metodologię dowodów naukowych oraz na zróżnicowanie efektów zdrowotnych ocenianych w poszczególnych badaniach.
Oprócz oceny skuteczności klinicznej i bezpieczeństwa terapii, dokonano również oceny niezaspokojonej potrzeby zdrowotnej i wielkości populacji docelowej, a dopełnieniem procesu oceny technologii lekowych była weryfikacja rekomendacji wydanych przez inne Agencji HTA w Europie i na świecie.
Technologie lekowe o wysokiej wartości klinicznej po opracowaniu materiałów analitycznych zostały wyłonione przez ekspertów Rady Przejrzystości w kilku etapach, które obejmowały wstępną selekcję leków o dużej skuteczności klinicznej, szczegółową ocenę oraz dyskusję poszczególnych technologii lekowych przez Zespoły Rady i finalną weryfikację na posiedzeniu Rady w pełnym składzie.

W oparciu o metodykę i biorąc pod uwagę opinię Rady Przejrzystości, zgodnie z art. 40a ust. 8 ustawy o refundacji utworzono wykaz technologii lekowej o wysokiej wartości klinicznej. Wykaz ten jest przygotowywany przez Agencję jednorazowo.
W wykazie TLK ujęto 35 technologii lekowych.
- Zinplava (bezlotoksumab) – zapobieganie nawrotom zakażenia wywoływanego przez Clostridium difficile u osób dorosłych z wysokim ryzykiem nawrotu zakażenia Clostridium difficile;
- Jorveza (budezonid) – eozynofilowe zapalenie przełyku u osób dorosłych (w wieku powyżej 18 lat);
- Epidyolex (kannabidiol) – napady padaczkowe związane z zespołem Lennoxa-Gastauta u osób w wieku 2 lat lub starszych w skojarzeniu z klobazamem;
- Epidyolex (kannabidiol) – napady padaczkowe związane z zespołem Dravet u osób w wieku 2 lat lub starszych w skojarzeniu z klobazamem;
- Reagila (kariprazyna) – schizofrenia u pacjentów dorosłych;
- Tecartus (autologiczne transdukowane anty-CD19 komórki CD3-dodatnie) – nawrotowy lub oporny na leczenie chłoniak z komórek płaszcza u dorosłych pacjentów, którzy uprzednio otrzymali co najmniej dwie linie leczenia systemowego, w tym inhibitor kinazy tyrozynowej Bruton;
- Kymriah (tisagenlecleucel) – ostra białaczka limfoblastyczna z komórek B, oporna na leczenie, która znajduje się w fazie nawrotu po transplantacji lub w fazie drugiego bądź kolejnego nawrotu u dzieci, młodzieży i młodych dorosłych w wieku do 25 roku życia włącznie;
- Kymriah (tisagenlecleucel) – nawrotowy lub oporny na leczenie chłoniak rozlany z dużych komórek B, po dwóch lub większej liczbie linii leczenia systemowego u osób dorosłych;
- Yescarta (aksykabtagen cyloleucel) – nawrotowy lub oporny na leczenie chłoniak rozlany z dużych komórek B, po dwóch lub większej liczbie linii leczenia systemowego u osób dorosłych;
- Yescarta (aksykabtagen cyloleucel) – pierwotny chłoniak śródpiersia z dużych komórek B, po dwóch lub większej liczbie linii leczenia systemowego u osób dorosłych;
- Oxervate (cenegermina) – umiarkowane (trwały ubytek nabłonka rogówki) lub ciężkie (wrzód rogówki) neurotroficzne zapalenie rogówki u osób dorosłych;
- Imfinzi (durwalumab) – pierwsza linia leczenia rozległego drobnokomórkowego raka płuca u osób dorosłych w skojarzeniu z etopozydem i karboplatyną lub cisplatyną;
- Mylotarg (gemtuzumab ozogamicin) – wcześniej nieleczona ostra białaczka szpikowa z ekspresją antygenu CD-33 de novo, z wyjątkiem ostrej białaczki promielocytowej, u osób w wieku 15 lat i starszych, w skojarzeniu z daunorubicyną i cytarabiną;
- Veltassa (patiromer ) – hiperkaliemia u osób dorosłych;
- Luxturna (woretygen neparwowek) – dziedziczna dystrofia siatkówki spowodowana przez potwierdzone bialleliczne mutacje genu RPE65 u dzieci, młodzieży i osób dorosłych z utratą wzroku, u których zachowała się wystarczająca liczba żywych komórek siatkówki;
- Amgevita (adalimumab) – czynne ropne zapalenie apokrynowych gruczołów potowych o nasileniu umiarkowanym do ciężkiego u osób dorosłych i młodzieży w wieku od 12 lat, u których konwencjonalne leczenie układowe jest nieskuteczne;
- Amsparity (adalimumab) – czynne ropne zapalenie apokrynowych gruczołów potowych o nasileniu umiarkowanym do ciężkiego u osób dorosłych i młodzieży w wieku od 12 lat, u których konwencjonalne leczenie układowe jest nieskuteczne;
- Hefiya (adalimumab) – czynne ropne zapalenie apokrynowych gruczołów potowych o nasileniu umiarkowanym do ciężkiego u osób dorosłych i młodzieży w wieku od 12 lat, u których konwencjonalne leczenie układowe jest nieskuteczne;
- Hulio (adalimumab) – czynne ropne zapalenie apokrynowych gruczołów potowych o nasileniu umiarkowanym do ciężkiego u osób dorosłych i młodzieży w wieku od 12 lat, u których konwencjonalne leczenie układowe jest nieskuteczne;
- Hyrimoz (adalimumab) – czynne ropne zapalenie apokrynowych gruczołów potowych o nasileniu umiarkowanym do ciężkiego u osób dorosłych i młodzieży w wieku od 12 lat, u których konwencjonalne leczenie układowe jest nieskuteczne;
- Idacio (adalimumab) – czynne ropne zapalenie apokrynowych gruczołów potowych o nasileniu umiarkowanym do ciężkiego u osób dorosłych i młodzieży w wieku od 12 lat, u których konwencjonalne leczenie układowe jest nieskuteczne;
- Imraldi (adalimumab) – czynne ropne zapalenie apokrynowych gruczołów potowych o nasileniu umiarkowanym do ciężkiego u osób dorosłych i młodzieży w wieku od 12 lat, u których konwencjonalne leczenie układowe jest nieskuteczne;
- Apixaban Accord (apiksaban) – zapobieganie udarom mózgu i zatorowości systemowej u osób dorosłych z niezastawkowym migotaniem przedsionków z co najmniej jednym czynnikiem ryzyka, takim jak przebyty udar mózgu lub przemijający napad niedokrwienny; wiek ≥ 75 lat; nadciśnienie tętnicze; cukrzyca; objawowa niewydolność serca (klasa wg NYHA ≥ II);
- Roteas (edoksaban) – zapobieganie udarom mózgu i zatorowości systemowej u osób dorosłych z niezastawkowym migotaniem przedsionków, z co najmniej jednym czynnikiem ryzyka, takim jak zastoinowa niewydolność serca, nadciśnienie tętnicze, wiek ≥ 75 lat, cukrzyca, przebyty udar mózgu lub przemijający napad niedokrwienny;
- Zubsolv (buprenorfina + nalokson) – leczenie substytucyjne uzależnienia od narkotyków opioidowych w ramach leczenia medycznego, społecznego i psychologicznego. Przeznaczone dla osób dorosłych i młodzieży w wieku powyżej 15 lat wyrażających zgodę na leczenie uzależnienia;
- Cabazitaxel Accord (kabazytaksel) – oporny na kastrację rak gruczołu krokowego z przerzutami u osób dorosłych, leczonych wcześniej schematem chemioterapii zawierającym docetaksel w skojarzeniu z prednizonem lub prednizolonem;
- Braftovi (enkorafenib) – przerzutowy rak jelita grubego z obecnością mutacji BRAF V600E, u osób dorosłych, u których wcześniej stosowano leczenie systemowe, w skojarzeniu z cetuksymabem;
- Kaftrio (iwakaftor + tezakaftor + eleksakaftor) – mukowiscydoza u osób w wieku co najmniej 12 lat, z homozygotyczną mutacją F508del genu mukowiscydozowego przezbłonowego regulatora przewodnictwa lub heterozygotyczną mutacją F508del genu CFTR z minimalną wartością funkcji w schemacie leczenia skojarzonego z iwakaftorem w dawce 150 mg w postaci tabletek;
- Takhzyro (lanadelumab) – profilaktyka nawracających napadów dziedzicznego obrzęku naczynioruchowego u osób w wieku 12 lat i starszych;
- Lenalidomide Accord (lenalidomid) – noworozpoznany szpiczak mnogi po autologicznym przeszczepie komórek macierzystych, u osób dorosłych w monoterapii w leczeniu podtrzymującym;
- Lenalidomide Mylan (lenalidomid) – noworozpoznany szpiczak mnogi po autologicznym przeszczepie komórek macierzystych, u osób dorosłych w monoterapii w leczeniu podtrzymującym;
- Prasugrel Mylan (prasugrel) – profilaktyka zdarzeń sercowo-naczyniowych u osób dorosłych z ostrymi zespołami wieńcowymi (tj. niestabilną dławicą piersiową, zawałem mięśnia sercowego bez uniesienia odcinka ST) poddawanych pierwotnej lub odroczonej przezskórnej interwencji wieńcowej w skojarzeniu z kwasem acetylosalicylowym;
- Prasugrel Mylan (prasugrel) – profilaktyka zdarzeń sercowo-naczyniowych u osób dorosłych z zawałem mięśnia sercowego z uniesieniem odcinka ST poddawanych pierwotnej lub odroczonej przezskórnej interwencji wieńcowej w skojarzeniu z kwasem acetylosalicylowym;
- Symkevi (tezakaftor + iwakaftor) – mukowiscydoza u osób w wieku co najmniej 6 lat, z homozygotyczną mutacją F508del w skojarzeniu z iwakaftorem w dawce 150 mg w postaci tabletek;
- Symkevi (tezakaftor + iwakaftor) – mukowiscydoza u osób w wieku co najmniej 6 lat, z heterozygotyczną mutacją F508del i jedną z następujących mutacji genu mukowiscydozowego przezbłonowego regulatora przewodnictwa : P67L, R117C, L206W, R352Q, A455E, D579G, 711+3A→G, S945L, S977F, R1070W, D1152H, 2789+5G→A, 3272-26A→G i 3849+10kbC→T w skojarzeniu z iwakaftorem w dawce 150 mg w postaci tabletek.
W wykazie technologii lekowych o wysokiej wartości klinicznej z dnia 26 sierpnia 2021 r. przygotowanym przez Agencję zostały za rekomendacją Rady Przejrzystości uwzględnione niektóre technologie lekowe zawarte w obwieszczeniu Ministra Zdrowia z dnia 20 sierpnia 2021 r. w sprawie wykazu refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych na 1 września 2021 r. , tj.:
1) Kymriah (w isagenlecleucelum) – lek stosowany w programie lekowym B.65 – Leczenie chorych na ostrą białaczkę limfoblastyczną (ICD-10 C91.0),
2) Takhzyro (lanadelumab) – lek stosowany w programie lekowym B.122 – Leczenie zapobiegawcze chorych z nawracającymi napadami dziedzicznego obrzęku naczynioruchowego o ciężkim przebiegu.
Powyższe wynika, z faktu, że wykaz technologii lekowych o wysokiej wartości klinicznej został wydany przez Agencję przed dniem objęcia refundacją przedmiotowych technologii lekowych. Tym samym przedmiotowe technologie lekowe na dzień wydania wykazu spełniają wymogi dla technologii lekowych o wysokiej wartości klinicznej, określone w art. 2 pkt 24a ustawy z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz. U. z 2021 r., poz. 523), w tym wymóg braku finansowania ze środków publicznych do dnia wydania decyzji o objęciu refundacją.
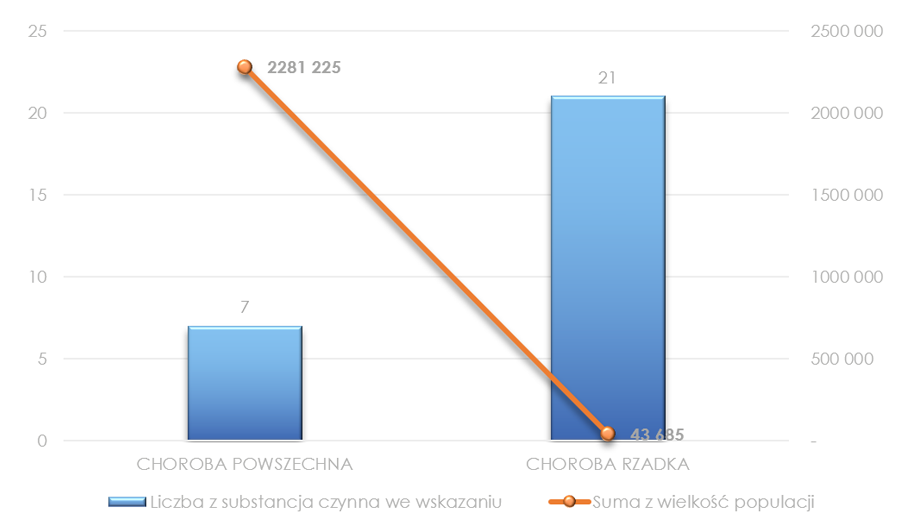
Technologie lekowe ujęte w wykazie są stosowane w 7 chorobach powszechnych i 21 chorobach rzadkich. Na podstawie zebranych danych, szacuje się, że leki ujęte w wykazie stanowią odpowiedź na potrzeby zdrowotne 2,324 mln osób w Polsce.
Wykres 5. Wielkość populacji oraz obszary terapeutyczne w wykazie TLK
Wykaz technologii lekowych o wysokiej wartości klinicznej jest pierwszym etapem
Utworzenie wykazu TLK jest pierwszym etapem prac w procesie refundacyjno-cenowym technologii lekowych o wysokiej wartości klinicznej. W następnych etapach wykaz będzie opiniowany przez konsultantów krajowych, Rzecznika Praw Pacjenta oraz Radę Przejrzystości, aby na tej podstawie utworzyć listę technologii lekowych o wysokiej wartości klinicznej.


